HPV检测技术总结国外版
HPV检测技术总结国外版
开展宫颈癌筛查可有效降低宫颈癌的发病率和死亡率。在北美、澳大利亚及欧洲等已有完善筛查制度的国家或地区。这令宫颈癌的发病率和死亡率有明显下降的趋势。但在发展中国家,宫颈癌的发病率和死亡率却没有明显改善。而我国是世界上最大的发展中国家,开展大规模宫颈癌筛查,对提高人类生命质量有着重要的推动作用。

截止到2019年5月,美国FDA相继批准了共有4家公司拿到了宫颈癌相关高危型HPV检测。除了我们熟知的Hybrid Capture 2,Cervista HPV,Cobas HPV和Aptima HPV外,BD开发的BD Onclarity HPV Assay也在2018年2月获得了FDA的认证,并且正在注册CFDA。
除Aptima HPV检测外,其余的产品虽然采用不同的技术原理,但都是检测HPV DNA的。Aptima HPV是唯一针对高危型HPV E6、E7 mRNA 的检测,也是目前唯一FDA批准的HPV E6/E7 mRNA检测。
HC2
Hybrid Capture 2简称HC2,于1997年由Digene公司开发,是FDA 最早批准用于诊断HPV的方法,在HPV检测领域作为“金标准”。
HC2-HPV-DNA的技术原理是第二代杂交捕获,本质上是采用RNA探针进行靶标捕获,利用抗体和酶进行信号放大,与现在大热的化学发光具有异曲同工之妙。
利用传统的微孔板,该法可定量检测13种高危型HPV DNA (16、18、31、33、35、39、45、51、52、56、58、59、68)。
简单来讲,含有靶标的HPV DNA宫颈细胞样本经过裂解处理,释放HPV DNA链段。释放的HPV DNA链段与HPV RNA探针进行鸡尾酒杂交,并进一步被相应抗体捕获到微孔板上。加入酶标二抗并与固定的杂交体结合后,被化学发光底物检出,发出的光信号在光度计上被测出相对光单位(RLU),该强度与HPV DNA的含量多少有关,并依次来定量。
由原理可以看出,该法最主要特点是不需要扩增,利用酶触化学发光进行信号放大。配合凯杰公司的自动化仪器,一个检测人员在8h内可以处理患者标本达352例,包括其间自动操作3.5小时。但该法主要限制也在于RNA探针与HPV DNA靶标之间的交叉反应。
Cervista HPV
Hologic是全球著名的医疗技术公司,公司主要通过早期检测和治疗为全球女性带来更多健康和福祉,特别是在乳腺、宫颈、微创手术和骨骼健康等领域,具有一定的领先地位。
Cervista HPV采用的方法是酶切信号放大法(英文可搜索Invader assay),该法与HC2的特点一样,也是不需要扩增的。但一方面与HC2采用化学发光进行信号放大不同,Cervista HPV由Cleavase酶特异性识别并切割目标DNA分子结构,通过识别目标DNA与信号放大两个步骤,直接检测特定核苷酸序列。
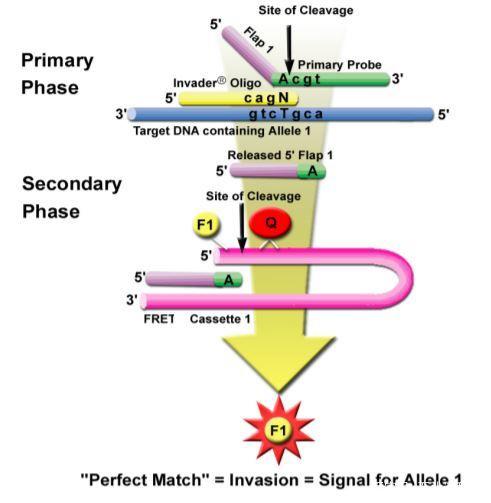
酶切信号放大
简单来讲,该法采用Invader寡核苷酸和寡核苷酸探针与靶向HPV DNA序列结合,由于设计了一个重叠序列,因此这两个探针与靶向HPV DNA序列形成了一个侵袭性结构。此时,裂解酶会在重复序列裂解产生许多5端片段,并进一步与通用的发夹荧光共振能量转移器(FRET) 寡核苷酸结合,形成另一个侵袭性结构。在裂解酶的作用下,荧光分子被释放,猝灭的荧光信号恢复。通过荧光信号的强弱就能判断靶向HPV DNA序列的有无。
Cobas HPV
Cobas 4800 HPV检测技术是罗氏公司于2009年11月在欧洲市场推出的。2011年4月,美国FDA批准Cobas 4800 HPV技术用于宫颈标本的检测。
罗氏作为全球顶尖的制药和诊断技术公司,其HPV DNA诊断技术依托其强大的自动化诊断平台Cobas 4800,该平台包括两个步骤:
①自动化样本核酸的分离与纯化
基本原理:样本在高温、蛋白酶、SDS及裂解液的处理下,DNA释放,再由磁珠颗粒吸附捕获。在磁性板架的配合下,通过低pH缓冲液进行DNA的清洗纯化。
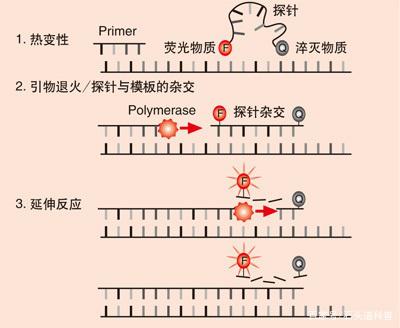
②目标DNA序列的PCR扩增及检测
添加PCR缓冲液和DNA聚合酶,完成PCR反应体系的建立,通过β-globin DNA和目标DNA的实时扩增和荧光检测完成整个过程。β-globin DNA的检测作为内质控,对样本的采集、DNA的提取及扩增检测进行全程监控。由于本质上Cobas 4800平台是采用实时荧光定量PCR,技术本身并不复杂,配合其自动化平台,已经能在医院的检验科、病理科、分子中心试验室及传染病研究所等广泛使用。
Aptima HPV
Aptima HPV最早由Gen-Probe公司研发,后来于2012年8月被Hologic收购。
FDA在2011年10月28日批准用于HPV检测的全自动分子诊断检测系统,也是最早的HPV E6/E7 mRNA 检测系统。
AptimaHPV所采用的技术是转录介导等温核酸扩增,具体原理如下图所示。
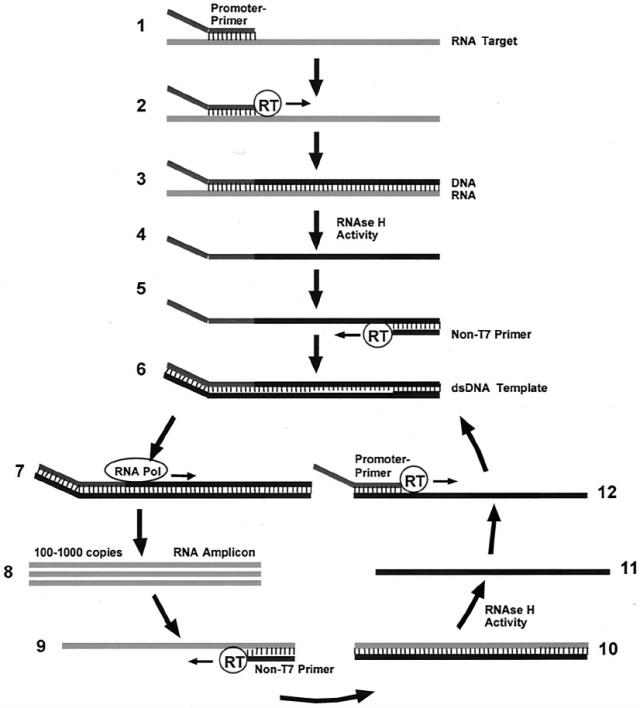
转录介导等温核酸扩增
转录介导的扩增技术以RNA为模板,利用RNA聚合酶和逆转录酶在约42 ℃等温反应条件下进行扩增,产物为RNA。该技术在每一循环可产生模板的100-1000个拷贝转录本。
检测HPV E6、E7 mRNA被称为第二代HPV检测技术。由于HPV E6、E7 mRNA是2个致癌蛋白翻译的模板,对其进行检测降低了传统HPV DNA检测对于一过性HPV感染的检出率,能识别出真正有癌变风险的HPV感染。
Onclarity HPV
BD Onclarity HPV Assay HPV检测技术由美国BD公司(Becton, Dickinson and Company)研发,于2018年2月12日由FDA批准的最新HPV检测方法。
该方法主要依托BD Viper LT系统,系统内部集成了核酸提取、扩增和检测,能自动进行样品处理、核酸提取、即时聚合酶链式反应(RT-PCR)扩增检测以及结果报告,将最小化降低人为干预,所采用的技术原理主要是实时荧光定量PCR。
与罗氏的产品不同,Onclarity 也是以HPV E6、E7 DNA作为靶点进行HPV检测,能一次性检测14种高危HPV(16,18,45,31,33,35,39,51,52,56,58,59,66和68)。
需要说明的是,目前国内海尔施也开发了一套基于HPV E6/E7 DNA分型检测试剂,并获得了CFDA和CE的认证。





